活动进行中
订购满5000元,200元礼品等你拿
凑单关联产品TOP5
NO.1. Microbial Viability Assay Kit-WST 微生物活性检测
NO.2. Biofilm Viability Assay 生物被膜药物杀伤效果检测
NO.3. Biofilm TestPiece Assay Kit 材料表面生物被膜形成能力检测
NO.4. CTC 细菌计数、染色
NO.5. Bacstain- CTC Rapid Staining Kit 细菌活力检测
规格性状
・Crystal Violet Solution 22 ml×1
・ 96-peg-Lid ×1
・ 96-well Plate ×10
在针状孔板盖(96-peg-Lid)的针状突起表面形成生物被膜
产品概述
生物被膜 (Biofilm)是一种主要由细菌体外的多糖组成的膜状复合体,可以在几乎所有的环境下广泛存在。医疗器具的细菌污染、龋齿、牙周炎等感染症等都与生物被膜的形成有关。由于生物被膜一旦形成,会对抗生素等药物产生抗性,进而引起严重的污染问题。因此,具有抑制生物被膜活性的药物和食品成分成为近年来的研究热点。
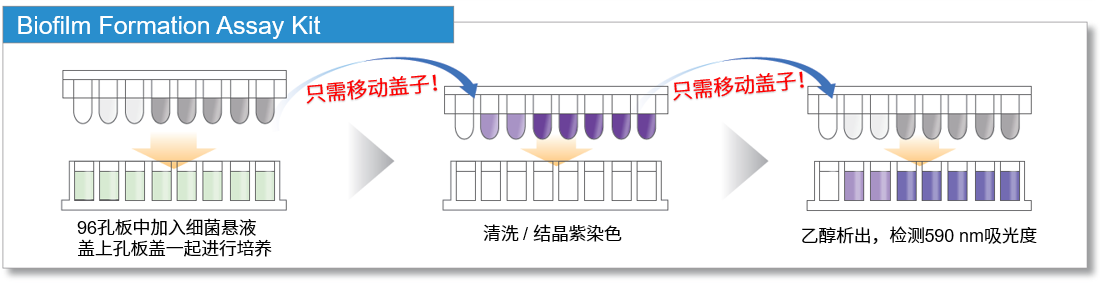
Biofilm Formation Assay Kit是通过结晶紫(Crystal Violet)法,对生物被膜形成量和药物对生物被膜抑制能力进行检测的试剂盒。检测过程中,生物被膜在孔板盖的针形突起表面生长,所以在清洗和染色操作中生物被膜不易脱落。同时,通过使用多孔板,可以一次性进行多样品检测。
结晶紫(Crystal Violet)染色法
1982年,Pedersen通过对比结晶紫(Crystal Violet)的吸光度与各种微生物生成的生物被膜的干燥重量,发现两者呈线性相关。因此结晶紫染色法作为最经典的生物被膜检测法一直沿用至今。
参考文献: K. Pedersen,”Method for Studying Microbial Biofilms in Flowing-Water Systems”, Appl. Environ. Microbiol., 1982, 43(1), 6.
特长和操作
Biofilm Formation Assay Kit的特长和操作
产品特点
特点① 检测时间大幅缩短
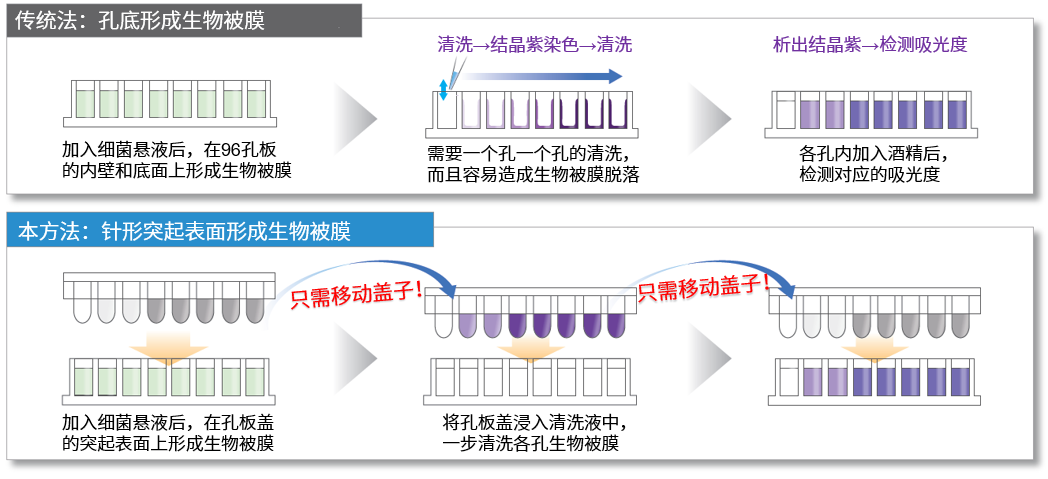
传统的多孔板检测方法是在96孔板的内壁和底部生成生物被膜,在细菌的培养和清洗等过程中,需要一个孔一个孔的进行操作,增加了大量的操作步骤和时间。而本试剂盒检测方法中,生物被膜在针状突起孔板盖的突起表面生成,只需移动孔板盖就可完成,使得操作变得异常简便。
特点② 减小复孔间的孔间差
由于传统法是在96孔板的内壁和底部形成生物被膜,在清洗等操作时非常容易造成生物被膜的脱落,所以复孔间的孔间差过大一直是传统方法的一大弊端。本试剂盒的方法是在孔板盖的突起处的表面形成生物被膜,大幅减少操作中生物被膜脱落的情况。


<使用本方法的参考文献>
T. Tsukatani, F. Sakata, R. Kuroda, “A rapid and simple measurement method for biofilm formation inhibitory activity using 96‑pin microtiter plate lids”, World J. Microbiol. Biotechnol., 2020, doi:10.1007/s11274-020-02964-6.
I. Okamoto etc., “Antibacterial and Antibiofilm Photodynamic Activities of Lysozyme-Au Nanoclusters/Rose Bengal Conjugates”, ACS Omega, 2021, doi: 10.1021/acsomega.1c00838
操作
本试剂盒可以对生物被膜形成量和药物对生物被膜抑制能力进行检测。检测过程中,生物被膜在孔板盖的针形突起表面生长,所以在清洗和染色操作中生物被膜不易脱落。同时,通过使用多孔板,可以一次性进行多样品检测。
产品选择指南
针对两种不同用途的试剂盒选择
使用针状孔板盖(96 Peg-Lid)的试剂盒一共有两款,分别通过结晶紫染色法和WST显色法进行检测,供您根据具体的需求自由选择。
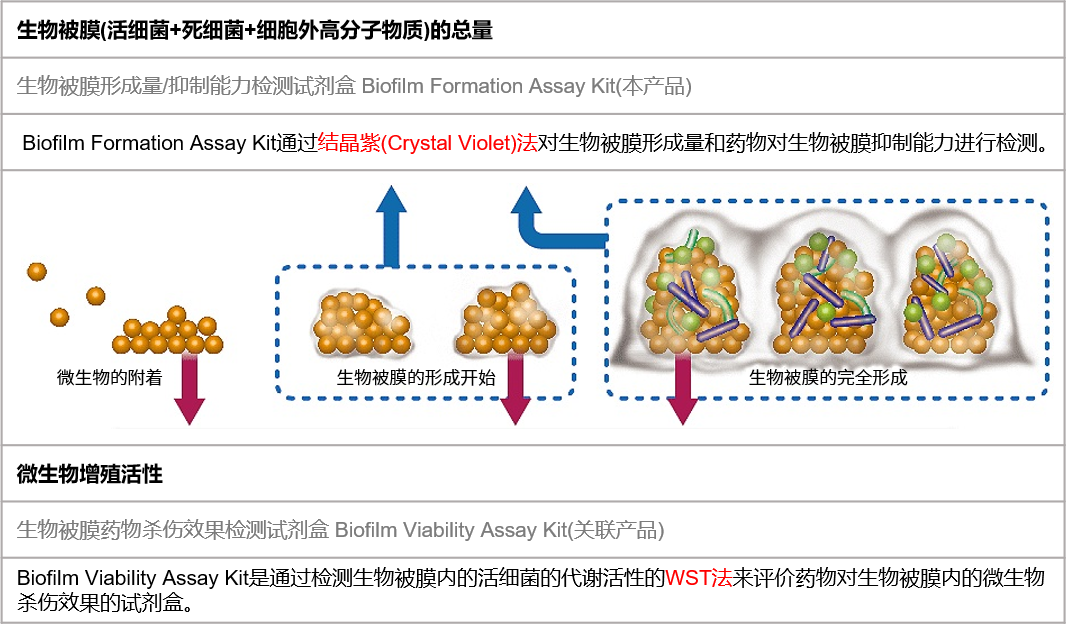
两种试剂盒的选择方法

*不同的菌种,生物被膜的形成条件(培养基、培养时间等)也不相同。建议先使用Biolfilm Formation Assay Kit(本产品)进行摸索。具体的摸索方法请参考FAQ “如何摸索生物被膜最佳实验条件”
*本试剂盒是由同仁化学研究所和日本福冈县工业技术中心—生物食品研究所共同开发。
Biofilm关联产品
本系列的其他产品介绍
用检测片评价抗菌材料对生物被膜的抑制能力
Biofilm TestPiece Assay Kit(货号:B606)
需要对抗菌材料的生物被膜抑制能力进行评价的时候,使用同仁化学研究所独自研发出的TestPiece Holder(检测片固定盖)可以大幅缩短检测时间,并且得到重现性更高的检测数据。


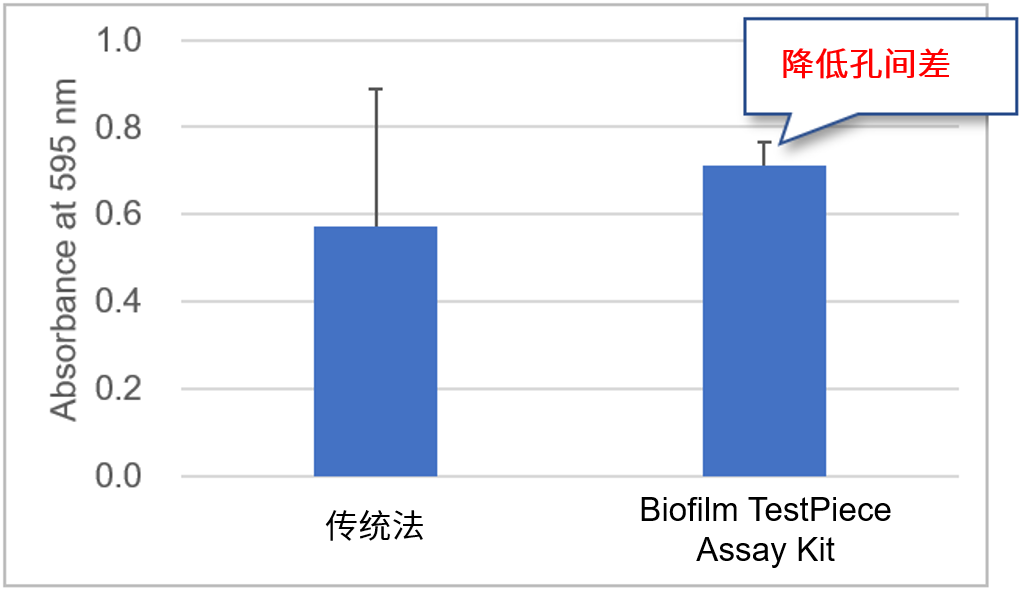
与传统法的比较
菌种:Staphylococcus aureus NBRC13276
复孔数: n=8
检测实例
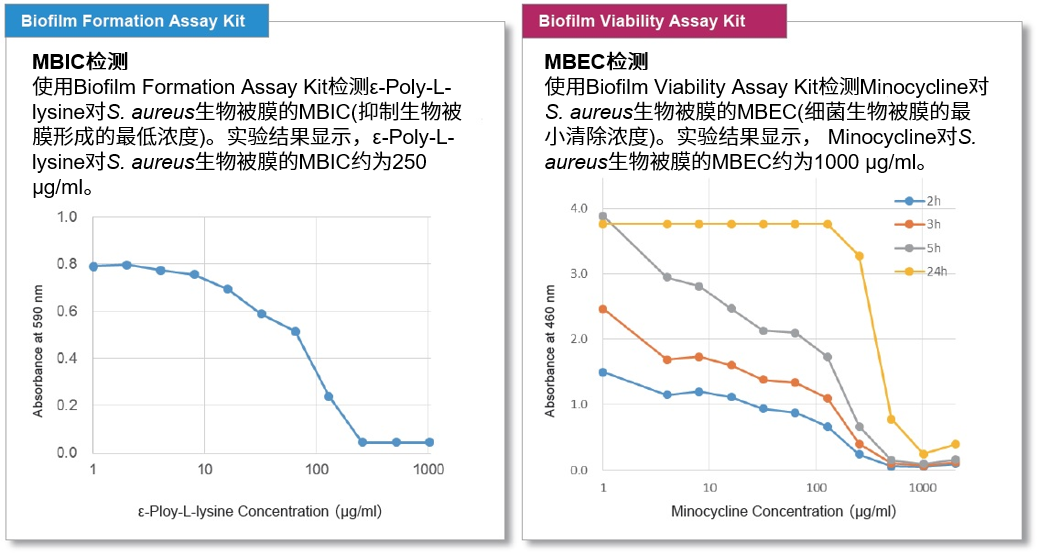
常见的生物被膜检测指标有两种:MBIC(Minimum Biofilm Inhibitory Concentrations,抑制生物被膜形成的最低浓度)和MBEC(Minimum Biofilm Eradication Concentrations,细菌生物被膜的最小清除浓度)。下面用各试剂盒分别检测对S.aureus(金黄葡萄球菌)的MBIC和MBEC。
常见问题Q&A
| Q: 如何摸索生物被膜的最佳实验条件? |
| A:一般对于生物被膜最佳实验条件的摸索项目有:培养基的种类、细菌的接种浓度、培养基的更换次数、培养时间、培养温度等。 下面针对培养基的种类、细菌的接种浓度、培养基的更换次数、培养时间作为检测实例进行摸索。如果要摸索培养温度的最佳条件,需要准备多个Biofilm Formation Assay Kit(B601)。
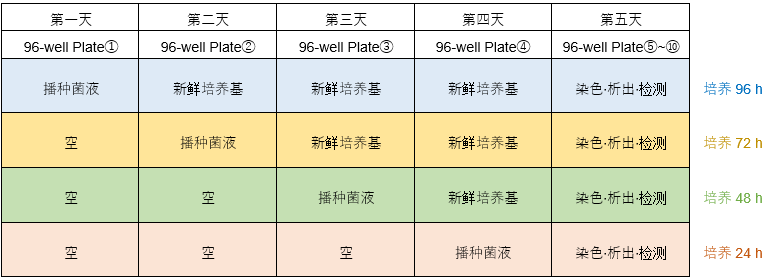
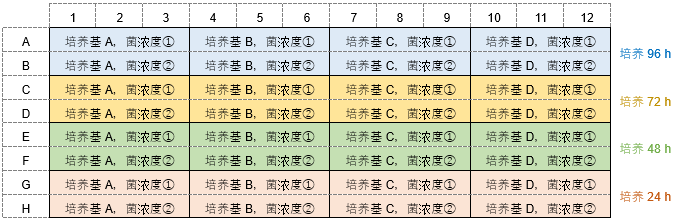
摸索实验例1 不同的培养基种类、细菌播种浓度、培养基交换条件下,检测生物被膜的形成量。 (孔板设置例)
日程表
*每隔24 h更换一次新的培养基。 操作步骤: 1)第1天:96-well Plate①的A行和B行的每个孔中播种180 μl用培养基A至D制备的浓度①和②的细菌溶液。C行~H行留空,盖上96-peg Lid,在适宜温度下培养24 h。 例: 细菌浓度①约107 CFU/ml,细菌浓度②约106 CFU/ml。 2) 第二天:将180 μl不含细菌的培养基加至96孔板②的A、B行的孔中。如图例所示,C、D行的各孔中加入180 μl培养基A~D配制的细菌浓度①和②细菌悬液。E行~H行留空。 将步骤1)中的96-peg Lid 盖在96-well Plate②上,在适宜温度下培养24 h。 3) 第三天:将180 μl不含细菌的培养基加至96-well Plate③的A行~D行各孔中,如图例所示,E、F行的各孔中加入180 μl培养基A~D配制的细菌浓度①和②细菌悬液。G、H行留空。 将步骤2)中的96-peg Lid 盖在96-well Plate③上,在适宜温度下培养24 h。 4) 第4天:将180 μl不含细菌的培养基加至96-well Plate④的A行~F行各孔中,如图例所示,G、H行的各孔中加入180 μl培养基A~D配制的细菌浓度①和②细菌悬液。 将步骤3)中的96-peg Lid 盖在96-well Plate④上,在适宜温度下培养24 h。 5)按照操作说明书的“生物被膜形成量 /生物被膜形成抑制能力”操作步骤的2~6,在新的96孔板中进行操作。 摸索实验例2 不同的培养基种类、细菌播种浓度、培养时间条件下,检测生物被膜的形成量。 (孔板设置例)
日程表
1)第1天:96-well Plate①的A行和B行的每个孔中播种180 μl用培养基A至D制备的浓度①和②的细菌溶液。C行~H行留空,盖上96-peg Lid,在适宜温度下培养24 h。 例: 细菌浓度①约107 CFU/ml,细菌浓度②约106 CFU/ml。 2) 第二天:取下96-peg Lid,96-well Plate①的A行和B行不更换培养基,C、D行的各孔中加入180 μl培养基A~D配制的细菌浓度①和②细菌悬液。E行~H行留空。 重新将96-peg Lid 盖在96-well Plate①上,在适宜温度下培养24 h。 3) 第三天:取下96-peg Lid,96-well Plate①的A~D行不更换培养基。E、F行的各孔中加入180 μl培养基A~D配制的细菌浓度①和②细菌悬液。G、H行留空。 重新将96-peg Lid 盖在96-well Plate①上,在适宜温度下培养24 h。 4) 第4天:取下96-peg Lid,96-well Plate①的A~F行不更换培养基。G、H行的各孔中加入180 μl培养基A~D配制的细菌浓度①和②细菌悬液。 重新将96-peg Lid 盖在96-well Plate①上,在适宜温度下培养24 h。 5)按照操作说明书的“生物被膜形成量 /生物被膜形成抑制能力”操作步骤的2~6,在新的96孔板中进行操作。 |
| Q:目前有过检测实例的菌种有哪些? |
| A:目前Biofilm Formation Assay Kit(本产品)以及同系列产品Biofilm Viability Assay Kit (货号:B603)有过实际检测案例的菌种有:
・Staphylococcus aureus(金黄葡萄球菌) ・Pseudomonas aeruginosa(绿脓杆菌) ・Escherichia coli(大肠杆菌) ・Streptococcus mutans(虫牙的病原菌之一) ・Porphyromonas gingivalis(牙周病的发病原因之一)
以上菌种的详细培养条件等请参考产品说明书。 |
| Q:做细菌被膜抑制药物的药效评价时,生物被膜的形成量至少要达到什么程度? |
| A:使用Biofilm Formation Assay Kit (本产品)时,操作步骤的最后一步,检测结晶紫(CV)溶液的吸光度时,
O.D.在0.5(590 nm)以上为宜。 |