特点:
● 只需添加小分子量荧光试剂即可轻松检测线粒体
● 可以使用荧光显微镜进行活细胞成像
● 可以与附着的溶酶体染色剂同时染色

试剂盒内含

产品概述
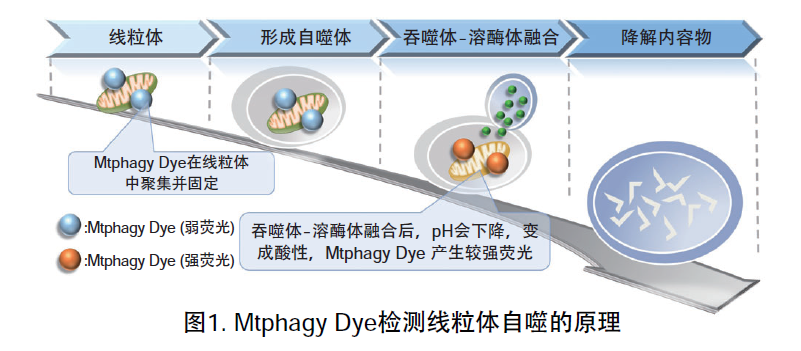
线粒体 (Mitochondria) 是细胞中重要的细胞器之一,可以为细胞活力提供能量 。近年有报道去极化线粒体的积累引起的阿尔茨海默病 (Alzheimer’s Disease) 与帕金森病(Parkinson’s Disease),可能与线粒体自噬有关。线粒体自噬是一种清除机制,可以通过自噬,将氧化应激、DNA损伤因素导致功能失调的线粒体隔离包裹成自噬体(Autophagosome),再与溶酶体 (Lysosome) 融合后降解。本试剂盒内含Mtphagy Dye (用于检测线粒体自噬) 和Lyso Dye (溶酶体染料)。Mtphagy Dye通过化学结合,固定在细胞内的线粒体上,会发出较弱的荧光。当线粒体发生自噬,损伤的线粒体会与溶酶体融合,pH会下降,变成酸性,此时Mtphagy Dye会产生较强的荧光。如想直观观察Mtphagy Dye标记的线粒体和溶酶体的结合,可联合应用试剂盒中的Lyso Dye (标记溶酶体) 进行双染。
特点:
1)只需添加小分子量荧光试剂即可轻松检测线粒体
2)可以使用荧光显微镜进行活细胞成像
3)可以与附着的溶酶体染色剂同时染色
原理
记载了本产品的检测原理和实验例的论文请看MD01论文实验例中第四篇:Live Cell Imaging of Mitochondrial Autophagy with a Novel Fluorescent Small Molecule
实验例
1.用羰基氰化物间氯苯腙 (CCCP,一种线粒体解偶联剂) 诱导Parkin表达的HeLa细胞线粒体自噬,并通过荧光显微镜进行检测。另外,通过与线粒体染色试剂(MitoBright Deep Red:MT08)一同染色,能够区分出已发生自噬的的线粒体(白色)和未发生自噬的线粒体(紫色)(照片:右侧)。

波长:
Mtphagy Dye:561 nm (Ex)、650 LP nm (Em)
Lyso Dye:488 nm (Ex)、502-554 nm (Em)
MitoBright Deep Red:640 nm (Ex)、656-700 nm (Em)
2.荧光显微镜观察
HeLa细胞用CCCP处理,并与线粒体检测试剂(Mtphagy Dye)和线粒体染色试剂(MitoBright LT Green)共同染色,并经过一段时间(6小时)后进行检测。
<检测条件>
设备:LSM-700 Laser scanning confocal microscope (LSCM)
(Carl Zeiss, Oberkochen, Germany)
激发波长:
MitoBright LT Green 488 nm
Mtphagy Dye 555 nm
物镜:63x
拍摄时间:6小时
拍摄间隔:15秒
3.自噬诱导和线粒体膜电位变化关系的检测
用羰基氰化物间氯苯腙(CCCP,一种线粒体解偶联剂)诱导Parkin表达的HeLa细胞线粒体自噬,并使用线粒体自噬检测试剂盒(Mitophagy Detection Kit:MD01)和线粒体膜电位检测试剂盒(JC-1 MitoMP Detection Kit:MT09)观察荧光结果。
结果证实在未经CCCP处理的细胞中几乎未检测到线粒体自噬的发生,并且线粒体膜电位正常维持。 另一方面,在添加了CCCP的细胞中,证实了线粒体膜电位的降低(JC-1的红色荧光降低)和线粒体自噬的发生(Mtphagy染料的荧光增强)。
<实验条件>
■将Parkin质粒导入HeLa细胞
使用HilyMax(货号:H357)将Parkin质粒引入HeLa细胞中(Parkin质粒/HilyMax试剂:0.1 μg/0.2 μl)
过夜培养后进行检测。
■线粒体自噬检测
向表达Parkin的HeLa细胞中添加0.1 μmol/l Mtphagy工作溶液,并在37°C下孵育30分钟。然后将细胞用HBSS洗涤,加入10 μg/ml CCCP/MEM溶液,并在37℃下孵育2小时。在荧光显微镜下观察细胞。
■线粒体膜电位检测
将10 μg/ml的CCCP/MEM溶液添加至表达Parkin的HeLa细胞中,并在37℃下孵育1.5小时。加入4 μmol/l的JC-1工作液使其终浓度达到2 μmol/l,并在37℃下孵育30分钟。孵育后,将细胞用HBSS洗涤,加入成像缓冲液,并在荧光显微镜下观察细胞。

<检测条件>
■线粒体自噬检测
Ex:561 nm,Em:570-700 nm
■线粒体膜电位检测
绿色Ex:488 nm,Em:500-550 nm
红色Ex:561 nm,Em:560-610 nm
荧光特性

